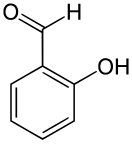
Салициловый альдегид
| Салициловый альдегид | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-гидроксибензальдегид | ||
| Традиционные названия | салициловый альдегид | ||
| Хим. формула | C7Н6O2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 122,12 г/моль | ||
| Плотность | 1,167 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −7 °C | ||
| • кипения | 196—197 °C | ||
| • вспышки | 90 °C | ||
| Давление пара | 0,075 кПа[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 8,37[2] | ||
| Растворимость | |||
| • в воде | 1,728 г/100 мл | ||
| • в бензоле | 64,612 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,5740 | ||
| Структура | |||
| Дипольный момент | 2,86 Д | ||
| Классификация | |||
| Рег. номер CAS | 90-02-8 | ||
| PubChem | 6998 | ||
| Рег. номер EINECS | 201-961-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | VN5250000 | ||
| ChEBI | CHEBI:16008 | ||
| ChemSpider | 13863618 | ||
| Безопасность | |||
| Краткие характер. опасности (H) |
H302, H315, H317, H319, H411 |
||
| Меры предостор. (P) |
P273, P280, P302+P352, P305+P351+P338 |
||
| Сигнальное слово | осторожно | ||
| Пиктограммы СГС |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Салициловый альдегид (орто-гидроксибензальдегид, 2-гидроксибензальдегид) о-НОС6H4CHO — бесцветная жидкость с резким и навязчивым фенольным («гуашевым») запахом и жгучим вкусом. Вместе с 3-гидроксибензальдегидом и 4-гидроксибензальдегидом принадлежит к простейшим ароматическим оксиальдегидам. Салицальдегид — ключевой прекурсор для различных хелатирующих агентов.
Физические свойства
[править | править код]Растворим в воде (1,72 г в 100 мл при 8°С), бензоле (64,6 г в 100 мл при 12°С), диэтиловом эфире, этаноле. Перегоняется с водяным паром[3]. Диэлектрическая проницаемость 17,09.
Получение
[править | править код]- Салициловый альдегид может быть получен из фенола и хлороформа в присутствии щелочи. Этот процесс называется реакцией Раймера-Тимана.

- Электролитическим восстановлением салициловой кислоты.
- Взаимодействием о-крезола с POCl3 или фосгеном при 120—150°С с последующим гидролизом образовавшегося фосфата или карбоната.
- Реакцией фенола с уротропином в присутствии борной кислоты (реакция Даффа).
- Альтернативный способ получения салицилового альдегида состоит в конденсации фенола с формальдегидом с последующим окислением образовавшегося гидроксибензилового спирта.

- В технике салициловый альдегид получают окислением ариловых эфиров ортокрезол-сульфокислоты, с помощью диоксида марганца в сернокислотном растворе, до соответствующих эфиров салицилового альдегида.
Нахождение в природе
[править | править код]В природе встречается в эфирном масле Spiraea ulmaria, Spiraea digitata. Также салициловый является веществом определяющим запах гречихи посевной[4].
Химические свойства
[править | править код]Салициловый альдегид обладает свойствами ароматических альдегидов: образует семикарбазон (т.пл. 231°С), фенилгидразон (т.пл. 143°С) и оксим (т.пл. 57°С). С гидразином образует нерастворимый в воде салицилальдазин:

При взаимодействии с уксусным ангидридом в присутствии ацетата натрия образует кумарин:

С пероксидом водорода в нейтральной среде образует салициловую кислоту, в щелочной среде — пирокатехин (реакция Дейкина). Вещество также обладает довольно сильными кислотными свойствами, что объясняется таутомерным превращением альдегида в хиноидную форму. Характерное свойство салицилового альдегида — образование окрашеных комплексов с ионами металлов. Так, с водным растовором FeCl3 он даёт фиолетовое окрашивание, с гидроксидом натрия — жёлтое с сине-зелёной люминесценцией при освещении УФ-излучением.
Применение
[править | править код]Салициловый альдегид применяют в органическом синтезе для получения пирокатехина, бензофурана[5], салицальдегид иминов, 3-карбетоксикумаринов.

В производстве красителей, как фунгицид, для количественного определения сивушного масла в этиловом спирте, в парфюмерии. В технике салициловый альдегид применяется для синтеза кумарина и некоторых красителей. Он является важным исходным соединением для синтеза ряда кислородсодержащих гетероциклов.
С аминами салициловый альдегид образует хелатирующие агенты. При реакции с этилендиамином образуется лиганд salen.
Примечания
[править | править код]- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16—29. — ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 5—96. — ISBN 978-1-4987-5428-6
- ↑ Химическая энциклопедия. Том 4. Москва, Большая российская энциклопедия, 1995, стр. 289
- ↑ Janeš, D.; Kreft, S. (2008). «Salicylaldehyde is a characteristic aroma component of buckwheat groats». Food Chemistry 109 (2): 293—298. doi:10.1016/j.foodchem.2007.12.032
- ↑ Burgstahler, A. W.; Worden, L. R. (1966). «Coumarone» (PDF). Org. Synth. 46: 28.; Coll. Vol. 5, p. 251